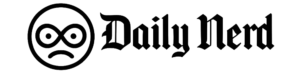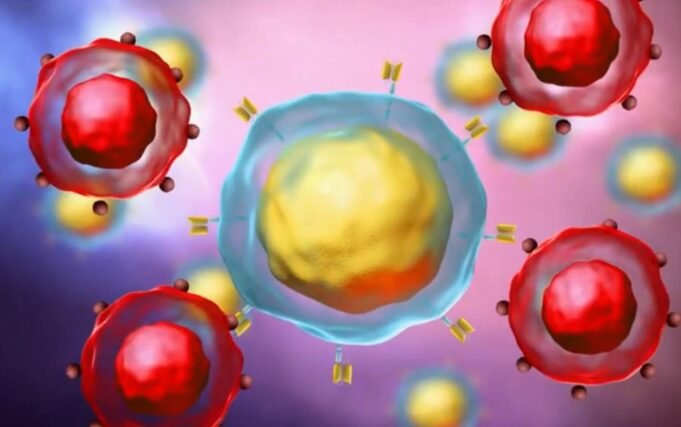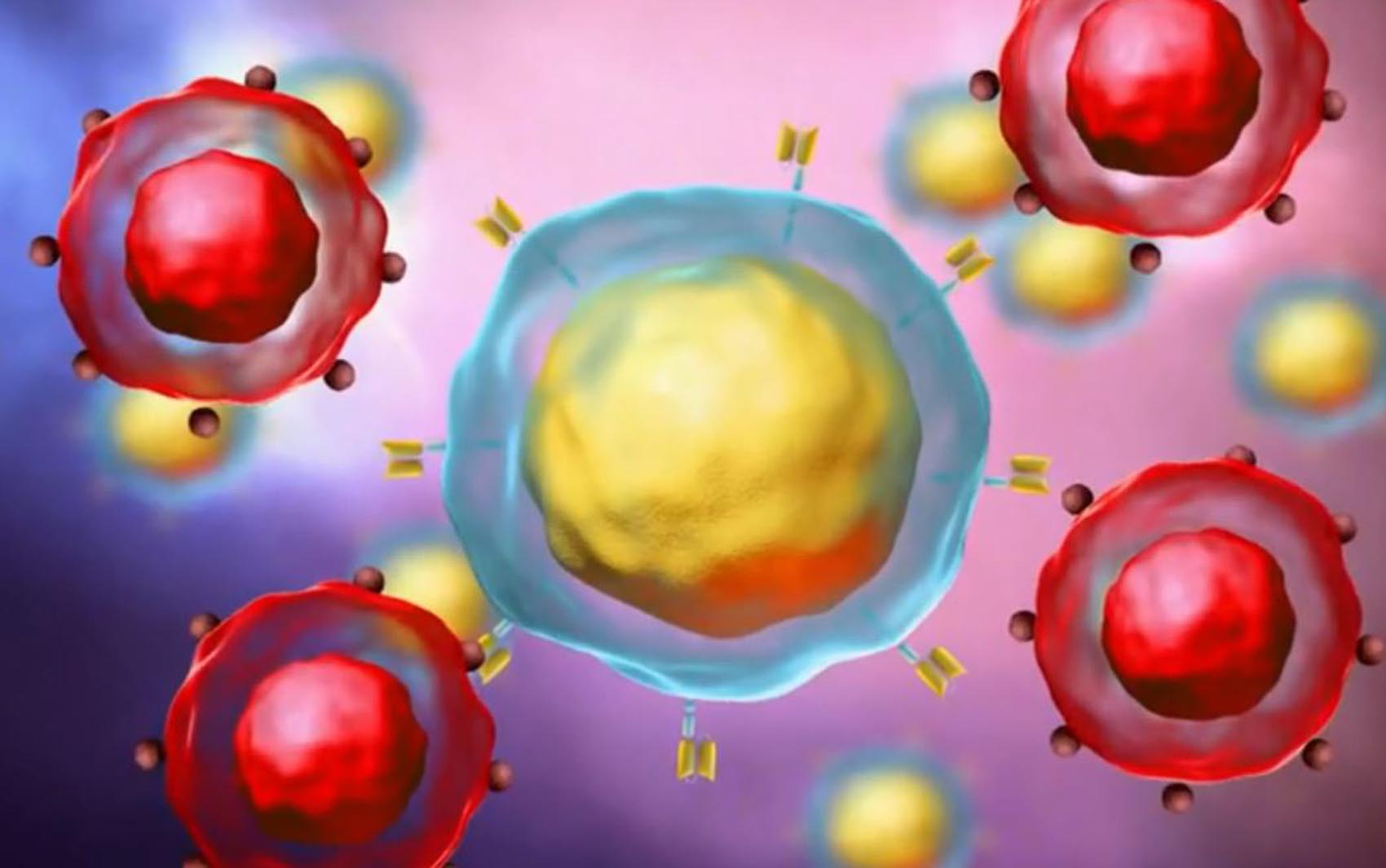
Entenda como funciona a terapia Car-T, que pode revolucionar o tratamento do câncer O Brasil registra um marco na história da oncologia. Pela primeira vez, uma terapia com células CAR-T – uma tecnologia altamente complexa, até agora limitada aos países ricos e à indústria farmacêutica – foi desenvolvida, produzida e aplicada inteiramente a nível nacional. E os resultados são considerados robustos: 81% de resposta e 72% de remissão completa em pacientes com linfomas, leucemias e outras neoplasias de células B refratárias a todas as terapias anteriores. O estudo, denominado CARTHIAE, foi conduzido pelo Hospital Einstein Israelita, financiado pelo Ministério da Saúde por meio do PROADI-SUS, e produzido em um hospital no Brasil como ensaio clínico Fase I do CAR-T aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa). Este é o primeiro caso de fabricação point-of-care na América Latina – quando a terapia é fabricada no mesmo local onde será aplicada. “Este é um marco histórico para a hematologia brasileira”, disse o hematologista Nelson Hammerschlak, coordenador do estudo. “Isto mostra que um país de rendimento médio pode produzir CAR-T de forma segura, eficaz e potencialmente a baixo custo”. Células CAR-T: Linfócitos retirados do paciente e modificados em laboratório voltam à corrente sanguínea e combatem células cancerígenas Hemocentro Ribeiro Prieto, SP Arte/TV Globo O que é CAR-T e por que é tão aguardado CAR-T é uma imunoterapia personalizada. As células T do próprio paciente são coletadas, geneticamente modificadas para reconhecer o tumor e devolvidas ao corpo para destruir as células doentes. É uma das tecnologias mais promissoras contra cancros hematológicos avançados, capaz de induzir remissão profunda mesmo em casos onde se considera não haver opções. Até agora, porém, o acesso sempre foi muito limitado por dois motivos: custos altíssimos – que podem chegar a R$ 2 milhões ou até R$ 3 milhões nas versões comerciais importadas – e total dependência da produção no exterior. As células precisam ser enviadas para um laboratório nos Estados Unidos ou na Europa, lá produzidas e enviadas de volta ao Brasil, processo que envolve logística complexa, internação prolongada e riscos clínicos durante a espera. Um estudo da Universidade Federal do Paraná, publicado no Journal of Medical Economics, mostra que essa dependência internacional é um dos principais fatores que proíbem o CAR-T no país. Embora seja rentável a longo prazo, uma vez que evita recaídas dispendiosas e melhora as taxas de cura, o preço inicial continua a ser uma barreira. A produção nacional tenta quebrar justamente esta barreira. COMO FOI FEITO O ESTUDO BRASILEIRO No estudo CARTHIAE, 11 pacientes receberam o CAR-T desenvolvido pelo Einstein. Eles tinham idades entre 9 e 69 anos e todos estavam em estágios avançados, com câncer que não havia respondido a nenhum tratamento anterior. Cada indivíduo foi submetido a quatro tratamentos prévios. Metade dos participantes tinha linfoma de células B e o restante tinha leucemia linfocítica aguda (LLA) ou leucemia linfocítica crônica (LLC) – dois tipos de câncer no sangue que podem ser especialmente difíceis de tratar quando se tornam refratários. A fabricação foi feita internamente por meio da plataforma Clinimax Prodigy, que permite um ciclo completo de fabricação – da coleta à infusão – sem depender de laboratórios externos. O tempo médio entre a retirada das células e a devolução do produto acabado (“veia a veia”) foi de 22 dias. A taxa de sucesso de produção foi de 100%, um indicador incomum mesmo em centros internacionais. “Produzimos em tempo real, com qualidade e com custos muito inferiores aos modelos comerciais”, afirma Hammerschlak. Células Kar-T: entenda a terapia celular contra o câncer aplicada experimentalmente Editoria de Arte/g1 Resultados: Estudo de alta remissão e segurança gerenciável registrou 81% de resposta geral e 72% de remissão completa. A sobrevida livre de progressão foi de 71% e a sobrevida global foi de 80% em um acompanhamento médio de 11 meses. A expansão das células CAR-T veio como esperado para tratar todos os tipos de câncer – LLA (leucemia linfoblástica aguda), LLC/LLC (leucemia linfocítica crônica) e vários linfomas de células B. As células modificadas permanecem no corpo por até um ano, indicando persistência da terapia ao longo do tempo. Os efeitos colaterais eram esperados para este tipo de terapia. A maioria dos pacientes apresentou febre e inflamação nas primeiras semanas, e alguns deles apresentaram alterações temporárias na função do sistema nervoso, como confusão ou sonolência. Todos estes sintomas foram controlados pelo tratamento e desapareceram após a administração do tratamento. car-t Hemocentro de Ribeirão Preto (USP)/arte g1 Por que mudar o acesso à manufatura no Brasil A manufatura nacional aborda corretamente as principais barreiras ao CAR-T importado: custo e tempo. Ao excluir a etapa internacional, muitos dos custos associados às importações deixam de existir, assim como o período crítico em que o paciente espera a chegada do produto. Segundo Hamerschlak, isso abre caminho para a ampliação de modelos de acesso – incluindo o Sistema Único de Saúde (SUS) – e a criação de uma rede cooperativa de centros nacionais capazes de produzir ou infundir CAR-T. “Se consolidarmos a produção em rede – Einstein, USP Ribeirão Preto, Butantan, Fiocruz/INCA, Mandakaru – será possível realmente aumentar o número de pacientes atendidos”, disse. Apresentação ao Ministério da Saúde O estudo recebeu financiamento de R$ 31,9 milhões do Ministério da Saúde por meio do PROADI-SUS. Segundo Hammerschlak, o apoio foi necessário porque atualmente no Brasil não existe um sistema específico de financiamento de terapias avançadas em estágio inicial – principalmente quando envolvem infraestrutura laboratorial complexa. O hematologista disse que a medida foi suficiente para fazer o ensaio funcionar, mas ressaltou que não resolve o debate principal, que é como – e se – a tecnologia poderá ser incorporada aos sistemas públicos no futuro. “O financiamento inicial permite o início do estudo, mas a discussão sobre o acesso é outra e ainda precisa ser abordada”, afirma. Próximos passos A equipe já está trabalhando em um cronograma para dar continuidade ao programa. A segunda fase do estudo terá início entre 2026 e 2027, paralelamente aos esforços para manter ativa a produção nacional – tanto com a tecnologia usada hoje no Einstein quanto com uma possível parceria com a Fiocruz. Existe também uma segunda linha de desenvolvimento. A hematologista Lucila Kerbau teve projeto aprovado pelo Pronon, programa federal de apoio à assistência oncológica, para desenvolver um vetor viral totalmente brasileiro para uso no CAR-T contra mieloma múltiplo. Produzido sob padrões GMP, um requisito para aplicação em humanos, esse vetor abre caminho para que futuras gerações de terapias sejam desenvolvidas inteiramente no país. Sobre a possível chegada do CAR-T ao SUS, o Ministério da Saúde informou ao g1 que esse processo ainda não está previsto. “Qualquer inclusão depende primeiro do registro do produto na Anvisa e depois da análise da Conitec, que avalia funcionalidade, segurança e custo-benefício antes de aprovar novas tecnologias para sistemas públicos”, disse o ministério em nota.